「化学反応式」のつくり方とは?化学変化を化学式で表そう
中学2年生の理科で学習する「化学反応式」について、化学変化を化学式で表す方法をわかりやすく解説するよ。
中学理科で覚える必要がある化学反応の式のつくりかたを、ひとつひとつくわしく説明。化学反応式のつくりかたのコツを確認しよう!
化学反応式とは
これまで、いろいろな「化学変化」を学習してきたよね。
鉄に硫黄を加えて、加熱をすると硫化鉄ができたとか、水を電気分解したら水素と酸素が出てきたとか。
ところで、この化学変化、いちいちこうやって「鉄に硫黄を加えて、加熱をすると硫化鉄ができた」なんていうように言葉で説明するのって大変だよね。
そこで便利なのが、今回学習する「化学反応式」なんだ。
たとえば、数学だって、「3に5を足すと8になる」と言葉で説明する代わりに、「3+5=8」と式で表すと便利だったりするよね。
なんたってシンプルだし、誰が表しても同じ式だから混乱しないし、世界共通だからね。
化学変化も、決められた記号を使ったり、ルールにそって式にすることで、確実に表すことができるんだ。
その決められた記号や、式にするときのルールをこれから学習しようね、ということだね。
ここまで実験や観察してきた物質の反応をわかりやすくまとめ、表すことができるのが化学反応式なんだ。使いこなせるようになるととっても便利な化学反応式を、楽しく学んでいこうね!
化学変化を化学式を使って表してみよう
これまでの学習では、物質を「化学式」を使ってあらわしてきたね。
じつは、この「化学式を使うこと」が化学反応式を作るときのルールのひとつなんだ。
化学式を使って化学変化を表すことができるようになるのが今回のたいせつなポイントだよ。
たとえば、前回学習してきた「鉄と硫黄の化学変化」を思い出してみよう。
「鉄と硫黄の化学変化」を化学反応式であらわそう
言葉で説明すると、「鉄に硫黄を加えて、加熱をすると硫化鉄ができる反応」だったね。
これを化学反応式で表すためには、まずそれぞれの物質を化学式で表してあげないとなんだ。
この化学変化の登場人物(物質)は「鉄・硫黄・硫化鉄」だよね。
この3人を化学式で言い換えるよ。
- 鉄:\(Fe\)
- 硫黄:\(S\)
- 硫化鉄:\(FeS\)
そしてこのこの3つの物質の関係性を表すと次のように式にすることができるよ。
\(Fe\) + \(S\) → \(FeS\)
これが鉄と硫黄の化学反応式だよ。
この式を見れば、
「鉄 に 硫黄 を加えると 硫化鉄になる」という関係が分かるよね。
式には、記号が使われているね。
「+」は、「ある物質に、ある物質を加える」という意味だね。
「→」は、「左辺にある反応前の物質が、化学変化をすることで、右辺の物質になる」ということを表しているんだよ。
数学と違って、「=」ではなく「→」を使うというところがポイントだね。
化学変化の場合は、「変化している」のだから、左辺の物質と、右辺の物質は「違うもの」だよね。だから「=(イコール)」ではないんだよ。
(ちなみに「加熱する」ことによって化学変化が起きる場合、→の下に「△」を描くこともあるよ)
まとめると、
- ➀その化学変化に登場する物質をそれぞれ「化学式」であらわす。
- ➁化学反応式のルールに従って、「+」「→」などの記号を使ってそれぞれの物質の関係をあらわす。
こうして、化学反応式を作ればいいんだね。
「水の電気分解」を化学反応式であらわそう
こんどは水の電気分解についても考えてみよう。
水を簡易電気分解装置に入れて電源装置につないで電気を流す実験だったね。
水に電気を流して分解すると、水素の気体と酸素の気体が発生するんだったよね。
まずは、登場人物(物質)を化学式であらわしてみるよ。
登場するのは、「水・酸素・水素」だね。
- 水:\(H_{2}O\)
- 酸素:\(O_{2}\)
- 水素:\(H_{2}\)
「水を 電気分解すると 酸素と 水素にわかれる」というそれぞれの物質の関係性を式にすると次のようになるよ。
\(2H_{2}O\) → \(2H_{2}\) + \(O_{2}\)
どうだろう?さっきとはちょっとワケがまた違うね。
なぜなら、化学式の前に数字がついていたりしているよね。
この数字、もちろん適当ではないよ。
たとえば、水分子の化学式「\(H_{2}O\)」と水素分子「\(H_{2}\)」の前に数字の2がついているけれど、どうしてだかわるかな?
この数字は、それぞれの「分子が2こ分」ということをあらわしていて、この「2」がないとこの化学反応式は間違いになってしまうんだ。
なぜなら、化学反応式を作るときは、「反応の前後で原子の数が変わらない」ようにしなくてはいけないから。
化学反応式は、「化学変化の前後でどんな物質がどのくらいあったか、そして化学変化の後でどんな物質がどのくらいできたか」を簡単に化学式を使ってあらわすんだ。化学反応式でポイントになることは「反応の前後で原子の数が変わらない」こと。
たとえば、今回の水の電気分解。
たしかにパッと見ると、「水」から「酸素」と「水素」があたらしく生み出されたようにも思ってしまうかもしれない。
でも、実際は、「水」がそもそも「酸素原子」と「水素原子」からできていて、それが分かれて、分子となって出てきただけなんだよね。
つまり、化学変化では、「原子があらたに生み出されたり、あったはずの原子がきれいさっぱり無くなってしまうことはない」んだ。
だから、化学反応式を作るときは、左辺と右辺で、登場している物質の原子の数が増えたり減ったりしないように気をつけて、「原子の数」が変わらないようにしなくてはいけないんだ。
これも重要なルール。
このことをふまえて、原子の数が変わらないようにすると、どうして水分子や水素分子の前に「2」をつける必要があるのかを、くわしく説明するよ。
水の電気分解の化学反応式をもういちど見てみよう。
\(2H_{2}O\) → \(2H_{2}\) + \(O_{2}\)
まず、大前提として反応後の水素と酸素は、「気体」で発生するよね。
水素と酸素は、気体として存在するにはかならず分子になるんだったよね。
気体の水素と酸素の化学式は\(H_{2}\)と\(O_{2}\)だよね。
この2つの物質はどちらも原子ではなく分子として存在しているんだから、こう書く必要があるね。
だけど、そうなるとちょっと困るよね。
なぜなら、水は\(H_{2}O\)だよね?
そうすると\(H\)は2つあるのでいいけれど、\(O\)が1つしかないので、分子になるためには酸素原子がひとつ足りなくなってしまうよね。
1つの\(H_{2}O\)を分解したら\(H\)が2つ、\(O\)が1つだからね。
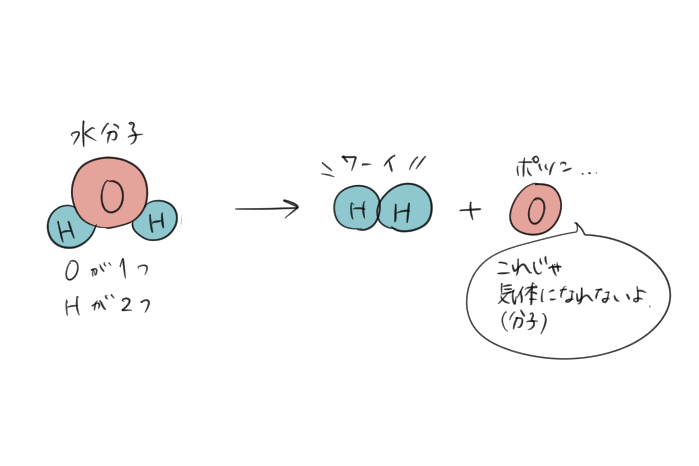
じゃあどうすればいいかというと、そもそもの水分子\(H_{2}O\)が2つあれば、\(H\)が4つ、\(O\)が2つになるから\(2H_{2}\)と\(O_{2}\)になって水素も酸素も正しくあらわすことができるというわけなんだ。
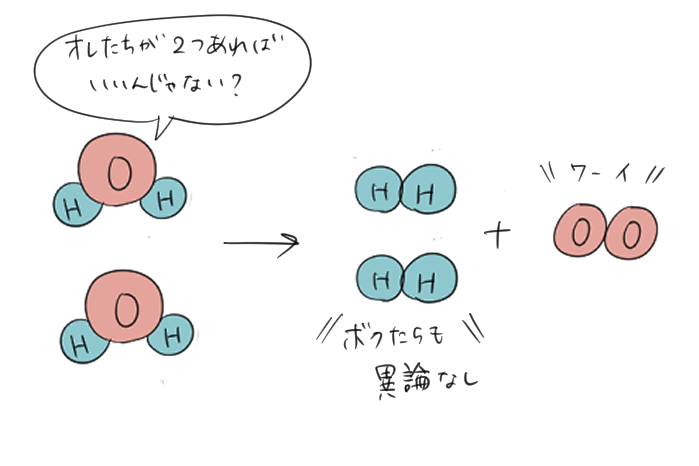
こんな風に化学反応式は反応の前後で原子が増えたり、なくなったりしないように、左辺と右辺の「原子の数が合う」ように調整をしてあげてつくる必要があるんだよ。
化学反応式のつくり方
化学反応式を作るときのルールを確認してきたけれど、ちょっと頭がこんがらがってきてしまったかもしれないね。
ここで、全部のルールを再確認しながらひとつひとつ見ていこう。
【ルール:化学反応式では「化学式」をつかって物質をあらわすべし!】
➀化学式で化学反応前の物質と化学反応後の物質をあらわす
【ルール:化学反応式では「+」「→」をつかって物質の関係性をあらわすべし!】
➁化学反応前の物質と化学反応後の物質を「+」や「→」でつなぐ
【ルール:化学反応式では、左辺と右辺の原子の数は変わってはいけない!】
③反応の前後の原子の数に注目する
④原子の数が合うように物質の数を考える
それではためしにやってみよう!
「水素と酸素が結びつく反応」を元に考えてみるよ。
水の電気分解とは反対の反応がおこるんだったね。
登場する物質は「水素・酸素・水」だね。
➀化学式であらわしてみよう。
- 水素:\(H_{2}\)
- 酸素:\(O_{2}\)
- 水分子:\(H_{2}O\)
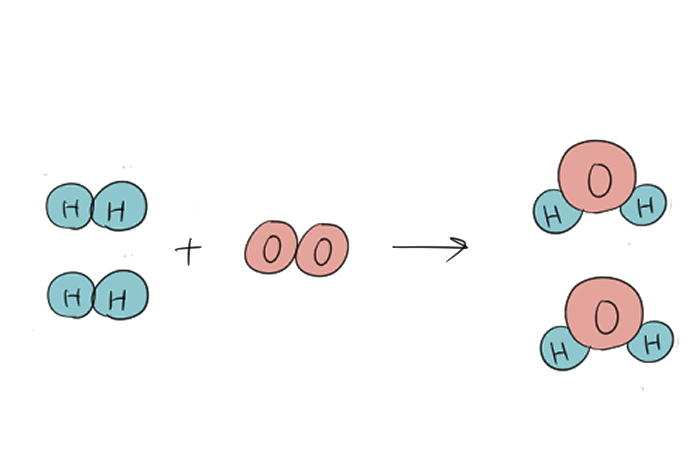
➁物質の関係性「水素に酸素を加えると、水分子になる」を「+」と「→」を使ってあらわすよ。
\(H_{2}\) + \(O_{2}\) → \(H_{2}O\)
となったよ。
③次に左辺(反応前)と右辺(反応後)のそれぞれの物質の原子の数が合っているかたしかめよう。
左辺の酸素は、気体だから分子になっていて、酸素原子は2つあるよね。
なのに、右辺の水分子の酸素原子の数は1つしかないから、足りないことがわかるね。
右辺の水分子の酸素原子の数だけを増やすわけにはいかないから、「水分子」ごと2つ分にしてみよう。
\(H_{2}\) + \(O_{2}\) → \(2H_{2}O\)
そうすると、酸素原子は無事2つ分にすることができたね。
これで左辺の酸素原子の数(2)と、右辺の酸素原子の数(2)が同じになったね。
ただ、今度は左辺の水素原子が2つなのに対して、右辺の水素原子は全部で4つ。
左辺の水素原子の数が足りなくなってしまったね。
だから、左辺(反応前)の水素分子を2つにしてあげよう。そうやって最終調整すると・・・・
④\(2H_{2}\) + \(O_{2}\) → \(2H_{2}O\)
これで、化学反応式の完成だよ。
化学反応式からわかることとは?
化学反応式からは、物質がどの原子どうしが結びついてできているか、そしてどんな物質に変化をしたかを知ることができるんだ。
化学式をつかって表しているから、「どんな原子がいくつあって」、「どんな関係で反応しているか」ということもわかるんだね。
これはとっても便利だね。
いろいろな化学反応式
ここまで実験してきた反応はすべてこの化学反応式で表すことができるよ。
ではまず実験を紹介したばかりの酸化銀の分解の化学反応式を作ってみよう。
酸化銀の熱分解を化学反応式であらわそう
➀化学反応前の物質と化学反応後の物質を化学式であらわす
酸化銀:\(Ag_{2}O\)
銀:\(Ag\)
酸素:\(O_{2}\)
➁化学反応前の物質と化学反応後の物質を「+」や「→」でつなぐ
反応前)\(Ag_{2}O\) → 反応後)\(Ag\)+\(O_{2}\)
反応前)酸化銀 → 反応後)銀+二酸化炭素
③反応の前後の原子の数に注目する
酸素は分子で気体になるはずだから、反応前と後で数が合わないね。銀の数も減ってしまっているから合わせないといけないそうすると、反応前の酸化銀の数を増やしてみよう。\(2Ag_{2}O\)にしてみよう。
そして、右辺の銀の数も増やすよ。
そうすると数が合うね!
④原子の数が合うように物質の数を考える
ここまでをまとめると
\(2Ag_{2}O\) → \(4Ag\) + \(O_{2}\)
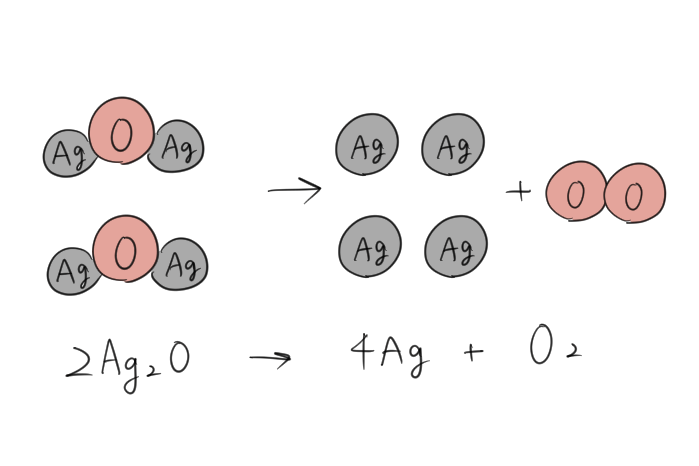
こんな風に「原子の数」に注目すると化学反応式が出来上がるよ。
テストでよく出る化学反応式
それじゃあ、次はそのなかでテストでもよく出る「炭酸水素ナトリウムの熱分解」をあらわしてみよう。
さっきと同じ手順で考えてみよう。
炭酸水素ナトリウムの熱分解の化学反応式をあらわそう
➀化学反応前の物質と化学反応後の物質を化学式であらわす
炭酸水素ナトリウム:\(NaHCO_{3}\)
炭酸ナトリウム:\(Na_{2}CO_{3}\)
水:\(H_{2}O\)
二酸化炭素:\(CO_{2}\)
➁化学反応前の物質と化学反応後の物質を「+」や「→」でつなぐ
\(NaHCO_{3}\) → \(Na_{2}CO_{3}\)+\(H_{2}O\) +\(CO_{2}\)
③反応の前後の原子の数に注目する
このままだと、炭酸ナトリウムに変化するためににナトリウム、ほかにも水や二酸化炭素に酸素、水素、炭素などが足りないことがわかるね。
反応後の原子の数をもとに考えると、どの物質の数を合わせるとよいかがわかるよ。
今回だと、炭酸水素ナトリウムが2つあれば、反応後の物質をつくるために必要な原子が全部そろうことがわかるよ。
④原子の数が合うように物質の数を考える
最後に数を正しくした化学反応式を書いてみるね。
\(2NaHCO_{3}\) → \(Na_{2}CO_{3}\)+\(H_{2}O\) +\(CO_{2}\)
この式は物質を表すための化学式が長く、反応後にできる物質が3種類あって忘れてしまうときもあるんだ。そんなときは次の3つのどれかを思い出せれば化学反応式を正しく書くことができるよ。ちょっと覚えておいてね。
炭酸水素ナトリウムの熱分解 化学反応式の思い出し方
1つ目:炭酸水素ナトリウムの化学式には2をつけた(\(2NaHCO_{3}\) )
もとの物質は1種類なので、2がつくことを思い出せれば原子の数はわかる
2つ目:反応後にできる物質は炭酸ナトリウム+水+二酸化炭素だった
(これは言葉で思い出せればOK!)
3つ目:炭酸ナトリウムの化学式を思い出す( \(Na_{2}CO_{3}\)だったね)
化学反応式のなかでも反応後にできる物質が3つあるのはこの「炭酸水素ナトリウムの熱分解」の化学反応式くらいだよ。
だから心配しないで、練習してみるとすぐにできるようになると思うよ!ぜひ覚えてみてね!
運営者情報

檜垣 由美子(ゆみねこ)
詳しいプロフィールを見る
青山学院大学教育学科卒業。TOEIC795点。2児の母。2019年の長女の高校受験時、訳あって塾には行かずに自宅学習のみで挑戦することになり、教科書をイチから一緒に読み直しながら勉強を見た結果、偏差値20上昇。志望校の特待生クラストップ10位内で合格を果たす。 ※サイト全体の運営実績についてはこちらにまとめています。

-
-
すっごくわかりやすかったです!!また使わさせてもらいます!!


私立中学校に通うものです。現在中1で化学反応式にてこずっていたのですが、先生の分かりやすい説明で、理解させていただきました。